Sesión 4. Separación de mezclas
Como ya sabes, Química es una de las materias más interesantes y a la vez más desafiantes. Esta ciencia nos ayuda a comprender muchos de los fenómenos que suceden a nuestro alrededor de manera cotidiana.

En este blog explicaremos acerca de los métodos de separación de mezclas. Para comenzar, partiremos del hecho de que ya sabemos qué es una sustancia pura, una mezcla y los tipos de mezclas, revisados en sesiones anteriores.
En la realidad, es más fácil mezclar que separar, y en muchos casos el proceso más complicado de todos es la separación de las mezclas en sus diferentes componentes.
Para separar mezclas se usan los métodos de separación, éstos pueden ser físicos o químicos.

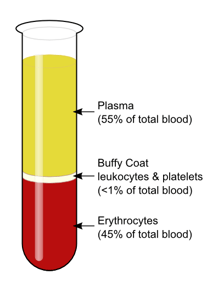
CENTRIFUGACIÓN
Al someter suspensiones o coloides a distintas velocidades de rotación, es posible separar sus componentes del más pesado al más ligero, al acelerarlos, los componentes más densos adquieren más fuerza que los menos densos, separándose así en sus distintos componentes. Un ejemplo es la centrifugación de la sangre.
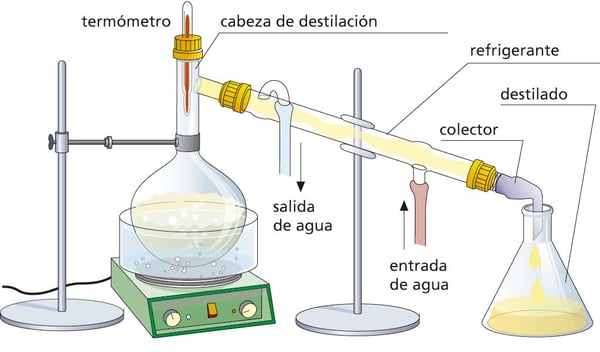
DESTILACIÓN
Este método sirve para separar soluciones aprovechando la diferencia de puntos de ebullición de los componentes de una mezcla. Consiste en calentar una mezcla hasta que ésta alcance el punto de ebullición de la sustancia que ebulle a menor temperatura, esta sustancia se evapora y se separa de la mezcla poco a poco, su vapor pasa entonces por un condensador para ser recuperado en un recipiente. Por ejemplo al destilar alcohol con agua.
CROMATOGRAFÍA
Este método permite analizar y separar los componentes de las mezclas al pasar a través de un soporte fijo o medio adsorbente que hace que los diferentes componentes queden adheridos a su superficie y se originen bandas de colores con la ayuda de un disolvente.

EVAPORACIÓN
Cuando se disuelven sólidos en líquidos, es posible evaporar todo el líquido hasta que sólo quede la sustancia que no se evaporó en el recipiente. Por ejemplo cuando separamos sales disueltas en agua como el cloruro de sodio en agua.

CRISTALIZACIÓN
Se usa para separar sólidos disueltos en líquidos, de manera que al comenzar la cristalización de lo sólidos, el disolvente es excluido del cristal. Por ejemplo, al separar el sulfato de cobre del agua, el cual se cristaliza al bajar la temperatura de la mezcla.

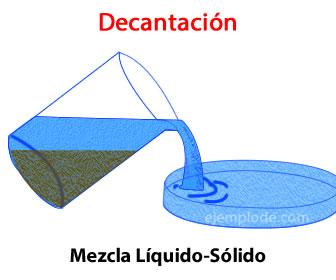
DECANTACIÓN
En mezclas que contienen sólidos y líquidos es posible separarlos tan sólo dejando que el sólido se deposite en el fondo y, después, retirar el líquido teniendo cuidado de no quitar parte del sólido en el fondo. Incluso cuando se tienen mezclas de dos componentes líquidos que no se mezclan, es posible decantarlas si se dejan reposar el tiempo suficiente para que ambas sustancias se separen por completo.
Por ejemplo el dicromato de potasio es poco soluble en agua, por lo que al mezclarse con el agua esta sal tiende a depositarse en el fondo del recipiente, haciendo posible separarlos por decantación.
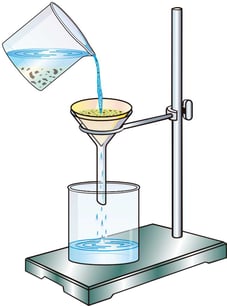
FILTRACIÓN
Este método se usa para separar sólidos mezclados con líquidos, de manera que no es posible decantar la mezcla. Entonces se hace pasar la mezcla a través de un material poroso, de tal manera que el líquido pasa a través de éste, pero el sólido no, separando así la mezcla. Por ejemplo, la separación de impurezas insolubles en el agua.
SUBLIMACIÓN
Hay ciertas sustancias que pueden pasar del estado sólido al gaseoso, del tal modo que cuando están presentes en una mezcla heterogénea, es posible separarlos convirtiendo un sólido en gas, es decir, sublimando este sólido. Por ejemplo el yodo mezclado con azufre, el yodo se sublima separándose del azufre.

IMANTACIÓN
Este método sirve para separar sustancias magnéticas de otras que no presentan magnetismo en mezclas heterogéneas. Por ejemplo, para separar limadura de hierro de arena.



Comentarios
Publicar un comentario